神経幹細胞グループ
グループリーダー 島崎琢也 准教授
背景1
中枢神経系の障害は生活の質を著しく低下させ、家族の負担が大きくなると伴に、発生する社会的コストも大きい。さらに、我が国を含む多くの先進国では高齢化社会が進行しており、それに伴い脳梗塞をはじめとした外傷性疾患やアルツハイマー病をはじめとした神経変性疾患に罹患する患者は増加する一方である。これらの疾患においては、加齢に伴い認知症が悪化の一途をたどるがゆえに、家族の精神的、肉体的および経済的負担は非常に重く、さらに、それらを含めた社会的コストの増大は既に社会問題化している。このような負担を軽減する手段は、現状ではこれらの疾患を対象とした予防医学の推進や認知症の進行を遅らせる薬剤による対処療法に限られている。近年、ヒトを含めた哺乳類成体脳においても神経幹細胞あるいは前駆細胞が絶対数は少ないものの存在し、脳の領域によっては神経新生を行っていることが明らかになり、これら前駆細胞を成長因子等の刺激により動因、つまり増幅および分化させ機能回復を促す脳損傷の治療モデルの開発も行われている。また、胎児脳やES細胞およびiPS細胞由来の神経幹・前駆細胞を用いた細胞移植治療モデルの研究も盛んに行われている。これらのことは、神経再生による中枢神経系障害の治療法の開発に希望の光をもたらしてはいるが、そこに辿り着くまでの道のりはまだまだ厳しいと言わざるを得ない。脳における細胞移植治療は、正常な神経回路網の再構築が可能かどうかも明らかではなく、副作用のリスクも大きい。
我々ヒトの中枢神経系は、幹細胞を含めて発生および老化の進行に伴って可塑性が低下していき、例えば外傷に対する再生能力および可塑性の高さは、様々な症例や動物実験の結果から“若い方が良い”というのは自明のこととされている。したがって、損傷を受けたヒト成体中枢神経系の回復は非常に限定的である。その一方、哺乳類より下等な脊椎動物においては中枢神経系損傷に対して驚異的な回復を示す種が多い。例えば、有尾両生類の一種であるブチイモリの成体脳においては、ドーパミン作動性神経やコリン作動性神経を薬剤によって選択的に変性・脱落させても自然再生されるが、哺乳類ではそのような事が起こることは決してなく、パーキンソン病や記憶障害の症状を呈するだけである。硬骨魚類においては脳の大きな切除を行っても元に戻る事例さえ報告されている。では、外傷や神経変性疾患により損傷を受けたり、老化によって機能が低下したりしたヒトの中枢神経系を、これら下等脊椎動物のように再生させることは不可能なのだろうか。もし成体神経幹・前駆細胞を胎児期のような可塑性を持った細胞に若返らせることができたら、ヒトにおいてもイモリや魚類のように損傷した中枢神経系を再生させることが可能になるかも知れない。それが我々の研究における究極の目標である。
研究内容
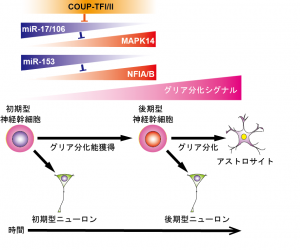
- 神経幹細胞分化の時間特異的制御機構の解明 (図1)
哺乳動物中枢神経系における神経幹細胞は、様々なタイプの神経細胞とグリア細胞へ分化できるが、発生過程において時間とともに分化する神経細胞のタイプが変化し、次第に神経新生能が低下しグリアへ分化しやすくなる。その後、成体においても神経新生を行っている側脳室下帯(aSVZ)と海馬歯状回顆粒下帯(SGZ)以外の領域ではほとんどがグリア細胞へ分化し、一部が潜在的幹細胞・前駆細胞として静的状態で残る。そして、老化の進行と伴にaSVZおよびSGZにおいても神経新生は低下し、潜在的前駆細胞の数も減少していく。つまり、神経幹細胞は発生の進行に伴って可塑性と増殖能が低下して行き、組織修復能も低下して行くのであるが、その制御機構については良く分かっていない。そこで我々は、近年その分子機構の解明に取り組んでいる。
COUP-TFI/IIによる神経幹細胞の時系列特異的分化能制御
我々の研究によって、オーファン型核内受容体の一種であるCOUP-TFIおよびIIの発現が胎生中期の中枢神経系の全ての領域の神経幹細胞で一過性に上昇し、それらが幹細胞のグリアへの分化能の獲得と発生初期型ニューロンへの分化能の消失に必須であることを示した2。しかしながら、未だその標的遺伝子を含めた下流の分子機構はよく分っておらず、現在その解明に取り組んでいる。その中で、最近、マイクロRNA(miRNA)の1つであるmiR-17とそのホモログmiR-106a/bが、COUP-TFI/II の下流において、細胞内シグナル伝達因子でタンパク質リン酸化酵素の一種であるp38MAP-kinaseの発現制御を介して神経幹細胞の神経新生からグリア分化期への移行を制御していることを発見した3。すなわち、miR-17/106は発生初期の神経新生期においては幹細胞で高発現しており、p38の発現を抑制することによってグリアへの分化を阻害しており、発生とともにmiR-17/106の発現が低下・消失し、逆にp38の発現が増加することがグリアへの分化能獲得に必須であることを示した。さらに、神経分化能が大きく低下し、グリアへの分化が優勢になった幹細胞にmiR-17を強制発現させると神経分化能が発生初期の神経新生期のレベルまでに回復させることができることを示した。現在は、グリア分化に必須でp38の活性化を促す細胞外シグナルとp38により活性化される機能分子の同定に取り組んでいる。
miR-153による神経幹細胞のグリアへ分化期への移行タイミングの制御
神経幹細胞のグリア分化能獲得に必須な転写因子として知られているNFIAおよびNFIBを標的としてそれらの発現を抑制し、グリア分化能獲得のタイミング制御に寄与しているmiRNAとしてmiR-153を同定した4。すなわち、miR-153は発生初期の神経新生期幹細胞で特異的に高発現し、NFIA/Bの発現抑制を介して幹細胞のグリアへの分化を抑制しており、発生の進行とともにその発現が低下し、NFIA/Bの発現が上昇することがグリアへの分化能獲得に必須であることを示した。 一方、胎生期から成体に至るまで主に神経細胞を生産しているaSVZにおいてはその発現の低下が見られないことから、miR-153の成体神経幹細胞による神経新生への関与も示唆された。miR-153の発現制御機構と成体神経幹細胞における役割の解明が今後の課題である。
図1.神経幹細胞分化の時間特異的制御
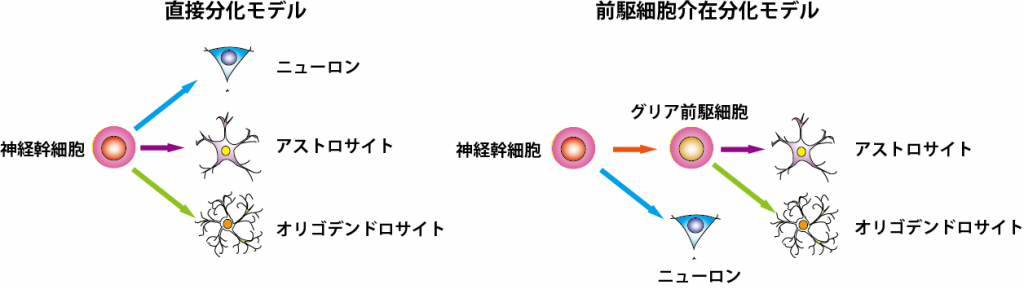
グリアの分化機構の解明 図2
神経幹細胞の自己複製および分化の制御機構に関しては、この20年で非常に多くの情報の蓄積があり、特に幹細胞 vsニューロンの分化機構については、Notchシグナルによる制御をはじめとした詳細な分子機構が明らかになってきている。その一方、幹細胞vsグリア細胞の分化機構に関しては、その分子機構の詳細において確定的なモデルは実は成立していない。これは、ニューロン分化に必須であるbHLH型転写因子群などの発現の有無により幹細胞と神経前駆細胞の区別は可能であるの対して、幹細胞とグリア前駆細胞を明確に区別する方法が確立されていないためである。それどころか、二種類のグリア細胞、すなわちアストロサイトとオリゴデンドロサイトが、幹細胞から直接分化するのか、あるいはそれらに共通なグリア前駆細胞という過程を経て分化するのかも定かではない。これまで、培養下におけるグリア前駆細胞様の細胞の分離は報告されているが、それらがどのように幹細胞から生まれてくるのか、また、in vivoにも存在し幹細胞と区別できるのかに関しては不明である。そこで現在、幹細胞とグリア前駆細胞(あるいはそれに相当する遷移状態)を区別する方法の開発に取り組んでいる。
図2.グリア細胞分化モデル(文献1より抜粋・改変)
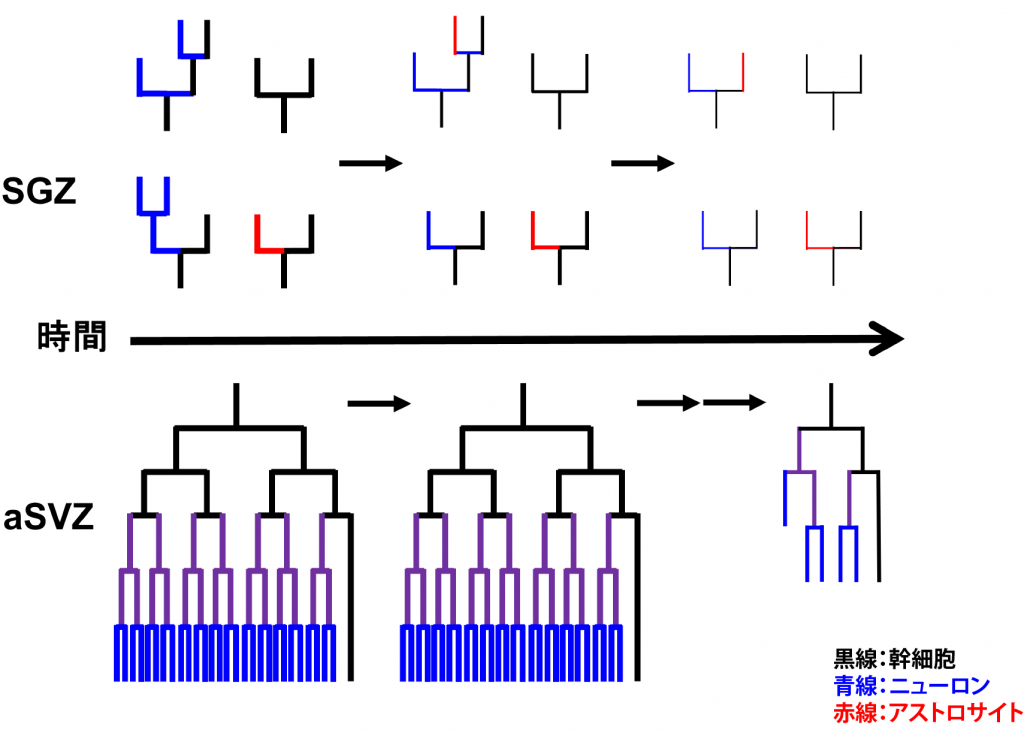
- 成体神経幹細胞の維持および可塑性の制御
神経幹細胞は成体においても神経新生を行っているaSVZとSGZ以外の領域ではほとんどがグリア細胞へ分化し、一部が潜在的幹細胞あるいは前駆細胞として静的状態で残る。これら成体神経幹細胞は、脳梗塞や外傷による損傷時には動員され主にグリアの供給源になることが示されている。そして、老化の進行と伴にaSVZおよびSGZにおいても神経新生は低下し、潜在的幹細胞の数も減少していく。つまり、神経幹細胞は発生の進行に伴って可塑性と増殖能が低下して行き、組織修復能も低下して行くのであるが、その制御機構についてはあまり良く分かっていない。また、aSVZとSGZでは幹細胞の性質が異なり、前者は成体においても長期間ほぼニューロンのみを一定量生産し続けるのに対して、後者は生後から加齢に伴って神経新生能は低下し、アストロサイトへ分化する比率も高くなるが(図3)、それらの違いが何に起因しているかは全く分かっていない。そこで、これらの違いを作っている分子機構を、それぞれの領域に存在する幹細胞がいかに老化し神経新生能を低下させていくかという観点から解明しようとしている。
図3.SGZとaSVZにおける神経幹細胞の分化系譜と加齢による神経新生の低下の模式図
文献
- Shimazaki T. Vertebrate Neural Stem cells: Development, Plasticity and Regeneration Keio J Med 2015, in press.
- Naka H, Nakamura S, Shimazaki T, Okano H: Requirement for COUP-TFI and II in the temporal specification of neural stem cells in CNS development. Nat Neurosci 11:1014-1023, 2008.
- Naka-Kaneda H, Nakamura S, Igarashi M, Aoi H, Kanki H, Tsuyama J, Tsutsumi S, Aburatani H, Shimazaki T, Okano H: The miR-17/106-p38 axis is a key regulator of the neurogenic-to-gliogenic transition in developing neural stem/progenitor cells. Proc Natl Acad Sci USA 111: 1604-1609, 2014.
- Tsuyama J, Bunt J, Richards LJ, Iwanari H, Mochizuki Y, Hamakubo T, Shimazaki T, Okano H: MicroRNA-153 regulates the acquisition of gliogenic competence by neural stem cells. Stem Cell Rep 2015, in press.